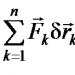– устойчивая цепная реакция, включающая горение , которое представляет собой экзотермическую реакцию, в которой окислитель, обычно кислород, окисляет горючее, обычно углерод, в результате чего возникают продукты сгорания, такие как диоксид углерода, вода, тепло и свет. Типичный пример – горение метана:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
Тепло, возникающее при горении, может использоваться для питания самого горения, и в случае, когда этого достаточно и дополнительной энергии для поддержания горения не требуется, возникает огонь. Чтобы остановить огонь, можно удалить горючее (отключить горелку на плите), окислитель (накрыть огонь специальным материалом), тепло (сбрызнуть огонь водой) или саму реакцию.
Горение, в некотором смысле, противоположно фотосинтезу , эндотермической реакции, в которую вступают свет, вода и диоксид углерода, в результате чего возникает углерод.
Есть искушение предположить, что при сжигании дерева используются углерод, находящийся в целлюлозе . Однако, судя по всему, происходит нечто более сложное . Если подвергнуть дерево воздействию тепла, оно подвергается пиролизу (в отличие от горения, не требующему кислорода), преобразующий её в более горючие вещества, такие, как газы, и именно эти вещества загораются при пожарах.
Если дерево горит достаточно долго, пламя исчезнет, но тление продолжится, и в частности дерево продолжит светиться. Тление – это неполное горение , в результате которого, в отличие от полного горения, возникает монооксид углерода .
Повседневные объекты постоянно излучают тепло, большая часть которого находится в инфракрасном диапазоне. Его длина волны больше, чем у видимого света, поэтому без специальных камер его не увидеть. Огонь достаточно ярок для того, чтобы выдавать видимый свет, хотя и инфракрасного излучения у него хватает.
Другой механизм возникновения цвета у огня – спектр излучения сжигаемого объекта. В отличие от излучения АЧТ, спектр излучения имеет дискретные частоты. Это происходит благодаря тому, что электроны порождают фотоны на определённых частотах, переходя из высокоэнергетического в низкоэнергетическое состояние. Эти частоты можно использовать для определения присутствующих в пробе элементов. Схожая идея (использующая спектр поглощения) используется для определения состава звёзд. Спектр излучения также отвечает за цвет фейерверков и цветного огня .
Форма пламени на Земле зависит от гравитации. Когда огонь разогревает окружающий воздух, происходит конвекция : горячий воздух, содержащий, помимо прочего, горячую золу, поднимается, а холодный (содержащий кислород), опускается, поддерживая огонь и придавая пламени его форму. При низкой гравитации, к примеру, на космической станции, этого не происходит. Огонь питается диффузией кислорода, поэтому горит медленнее и в виде сферы (поскольку горение происходит только там, где огонь соприкасается с содержащим кислород воздухом. Внутри сферы кислорода не остаётся).
Излучение абсолютно чёрного тела
Излучение АЧТ описывает формула Планка , относящаяся к квантовой механике. Исторически она была одной из первых применений квантовой механики. Её можно вывести из квантовой статистической механики следующем образом.Мы подсчитываем распределение частот в фотонном газе при температуре T. То, что оно совпадает с распределением частот фотонов, испускаемых абсолютно чёрным телом той же температуры, следует из закона излучения Кирхгофа . Идея в том, что АЧТ можно привести в температурное равновесие с фотонным газом (поскольку у них одинаковая температура). Фотонный газ поглощается ЧТ, также испускающим фотоны, так что для равновесия необходимо, чтобы для каждой частоты, на которой ЧТ испускает излучение, оно и поглощало бы его с той же скоростью, что определяется распределением частот в газе.
В статистической механике вероятность нахождения системы в микросостоянии s, если оно находится в тепловом равновесии при температуре T, пропорциональна
Где E s - энергия состояния s, а β = 1 / k B T, или термодинамическая бета (Т – температура, k B - постоянная Больцмана). Это распределение Больцмана . Одно из объяснений этого дано в блогпосте Теренса Тао. Это значит, что вероятность равна
P s = (1/Z(β)) * e - β E s
Где Z(β) – нормализующая константа
Z(β) = ∑ s e - β E s
Для описания состояния фотонного газа нужно знать что-то по поводу квантового поведения фотонов. При стандартном квантовании электромагнитного поля поле можно рассматривать как набор квантовых гармонических осцилляций , каждая из которых осциллирует с разными угловыми частотами ω. Энергии собственных состояний гармонического осциллятора обозначаются неотрицательным целым n ∈ ℤ ≥ 0 , которое можно интерпретировать, как количество фотонов частоты ω. Энергии собственных состояний (с точностью до константы):
В свою очередь, квантовая нормализующая константа предсказывает, что на низких частотах (относительно температуры) классический ответ приблизительно верен, но на высоких средняя энергия экспоненциально падает, при этом падение получается большим при меньших температурах. Это происходит потому, что на высоких частотах и низких температурах квантовый гармонический осциллятор большую часть времени проводит в основном состоянии, и не переходит так легко на следующий уровень, что вероятность чего экспоненциально ниже. Физики говорят, что большая часть этой степени свободы (свободы осциллятора колебаться на определённой частоте) «замораживается».
Плотность состояний и формула Планка
Теперь, зная, что происходит на определённой частоте ω, необходимо просуммировать по всем возможным частотам. Эта часть вычислений классическая и никаких квантовых поправок делать не надо.Мы используем стандартное упрощение, что фотонный газ заключён в объём со стороной длиной в L с периодическими граничными условиями (то есть, реально это будет плоский тор T = ℝ 3 / L ℤ 3). Возможные частоты классифицируются по решениям уравнения электромагнитных волн для стоячих волн в объёме с указанными граничными условиями, которые, в свою очередь, соответствуют, с точностью до множителя, собственным значениям лапласиану Δ. Точнее, если Δ υ = λ υ, где υ(x) – гладкая функция T → ℝ, тогда соответствующее решение уравнения электромагнитной волны для стоячей волны будет
υ(t, x) = e c √λ t υ(x)
И поэтому, учитывая, что λ обычно отрицательная, и значит, √λ обычно мнимый, соответствующая частота будет равна
ω = c √(-λ)
Такая частота встречается dim V λ раз, где V λ - λ-собственное значение лапласиана.
Упрощаем мы условия при помощи объёма с периодическими граничными условиями потому, что в этом случае очень просто записать все собственные функции лапласиана. Если использовать для простоты комплексные числа, то они определяются, как
υ k (x) = e i k x
Где k = (k 1 , k 2 , k 3) ∈ 2 π / L * ℤ 3 , волновой вектор . Соответствующее собственное значение лапласиана будет
λ k = - | k | 2 = - k 2 1 - k 2 2 - k 2 3
Соответствующей частотой будет
И соответствующей энергией (одного фотона этой частоты)
E k = ℏ ω k = ℏ c |k|
Здесь мы аппроксимируем вероятностное распределение по возможным частотам ω k , которые, строго говоря, дискретны, непрерывным вероятностным распределением, и подсчитываем соответствующую плотность состояний g(ω). Идея в том, что g(ω) dω должна соответствовать количеству доступных состояний с частотами в диапазоне от ω до ω + dω. Затем мы проинтегрируем плотность состояний и получим окончательную нормализующую константу.
Почему эта аппроксимация разумна? Полную нормализующую константу можно описать следующим образом. Для каждого волнового числа k ∈ 2 π / L * ℤ 3 существует число n k ∈ ℤ ≥0 , описывающее количество фотонов с таким волновым числом. Общее количество фотонов n = ∑ n k конечно. Каждый фотон добавляет к энергии ℏ ω k = ℏ c |k|, из чего следует, что
Z(β) = ∏ k Z ω k (β) = ∏ k 1 / (1 - e -βℏc|k|)
По всем волновым числам k, следовательно, его логарифм записывается, как сумма
Log Z(β) = ∑ k log 1 / (1 - e -βℏc|k|)
И эту сумму мы хотим аппроксимировать интегралом. Оказывается, что для разумных температур и больших объёмов подынтегральное выражение меняется очень медленно с изменением k, поэтому такая аппроксимация будет весьма близкой. Она перестаёт работать только при сверхнизких температурах, где возникает конденсат Бозе-Эйнштейна .
Плотность состояний вычисляется следующим образом. Волновые векторы можно представить в виде равномерных точек решётки, живущих в «фазовом пространстве», то есть, количество волновых векторов в некоем регионе фазового пространства пропорционально его объёму, по крайней мере, для регионов, крупных по сравнению с шагом решётки 2π/L. По сути, количество волновых векторов в регионе фазового пространства равно V/8π 3 , где V = L 3 , наш ограниченный объём.
Остаётся вычислить объём региона фазового пространства для всех волновых векторов k с частотами ω k = c |k| в диапазоне от ω до ω + dω. Это сферическая оболочка толщиной dω/c и радиусом ω/c, поэтому её объём
2πω 2 /c 3 dω
Поэтому плотность состояний для фотона
G(ω) dω = V ω 2 / 2 π 2 c 3 dω
На самом деле эта формула в два раза занижена: мы забыли учесть поляризацию фотонов (или, что эквивалентно, спин фотона), которая удваивает количество состояний для данного волнового числа. Правильная плотность:
G(ω) dω = V ω 2 / π 2 c 3 dω
То, что плотность состояний линейна в объёме V работает не только в плоском торе. Это свойство собственных значений лапласиана по закону Вейла . Это значит, что логарифм нормализующей константы
Log Z = V / π 2 c 3 ∫ ω 2 log 1 / (1 - e - βℏω) dω
Производная по β даёт среднюю энергию фотонного газа
< E > = - ∂/∂β log Z = V / π 2 c 3 ∫ ℏω 3 / (e βℏω - 1) dω
Но для нас важно подынтегральное выражение, дающее «плотность энергий»
E(ω) dω = Vℏ / π 2 c 3 * ω 3 / (e βℏω - 1) dω
Описывающее количество энергии фотонного газа, происходящее от фотонов с частотами из диапазона от ω до ω + dω. В итоге получилась форма формулы Планка, хотя с ней нужно немного поиграть, чтобы превратить в формулу, относящуюся к АЧТ, а не к фотонным газам (нужно поделить на V, чтобы получить плотность в единице объёма, и проделать ещё кое-что, чтобы получить меру излучения).
У формулы Планка есть два ограничения. В случае, когда βℏω → 0, знаменатель стремится к βℏω, и мы получаем
E(ω) dω ≈ V / π 2 c 3 * ω 2 /β dω = V k B T ω 2 / π 2 c 3 dω
Теги:
- огонь
- квантовая физика
Инструкция
Многие ошибочно называют горение огнем, но это неправильно. На самом деле огонь – лишь один из этапов горения. Если говорить еще конкретнее – это физическое явление рассматривает газы и плазму в совокупности. При этом причины их выделения могут быть различными – реакция или взрыв, воспламенение горючих материалов в присутствии окислителя. Одно из основных свойств огня – его высокая способность к самораспространению в соответствующих условиях. Но в некоторых случаях, например, во время горения химических веществ, пламя отсутствует полностью.
Для того чтобы возник огонь, необходимо выполнение сразу трех условий. Первое условие – наличие топлива, которое будет гореть. Следующее требование заключается в наличии окислителя, благодаря которому процесс горения может существовать. Последнее условие - температура должна соответствовать свойствам и окислителя, и топлива. Если хотя бы одно из условий не будет соблюдаться, то горение становится невозможным, поэтому огонь также не возникнет. При соблюдении всех требований наблюдается процесс горения, сопровождаемый огнем. Следует отметить, что огонь окрашивается в зависимости от вида топлива.
Горючими веществами считаются те, которые в присутствии окислителя способны возгораться. В зависимости от свойств различают несколько видов топлива. Если вещество не может самостоятельно гореть в присутствии окислителя, то их называют негорючими. А вещества, способные гореть исключительно в присутствии источника огня, принято называть трудногорючими веществами. И лишь те вещества, которые могут продолжать самостоятельно гореть даже после удаления источника огня, называются горючими веществами. Горючие вещества могут быть практически в любом агрегатном состоянии. Практически во всех веществах, обладающих прекрасными горючими свойствами, содержится некоторое количество химических примесей. Именно эти примеси и отвечают за цвет, которым будет обладать огонь после возгорания.
Так привычным оранжевым цветом обладает древесина, в то время, как красный цвет пламени появляется при сгорании кальция или лития. А для создания желтого необходимо использовать в качестве топлива горючее вещество с высоким содержанием натрия. Благородным голубым цветом характеризуется при горении природный газ, синий – если в топливе присутствует селен. Придает огню белый цвет присутствие в топливе титана или алюминия. Огонь становится фиолетово-розовым под воздействием калия, а под воздействием молибдена, сурьмы, меди, бария или фосфора – зеленым.
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Огонь свечи, огонь костра,
Огонь могучего пожара.
Огни - они все мастера
Ниспосланного людям дара.
Введение
Он может родиться, окрепнуть и вырасти. Может ослабнуть и умереть. Может быть трепетным и ласковым или жестоким и жадным. Он набрасывается, пожирает, поглощает. С ним можно бороться и он отступит побежденным. Он может спасти или обернуться жуткой трагедией.
«Огонь!» - это как возглас надежды заплутавшего, так и суровая команда, несущая смерть врагам.
Огненные волосы, горящие глаза, испепеляющий взгляд. Вспышка гнева, взрыв смеха. Играть с огнем, загореться мыслью, пылать энтузиазмом, гореть страстью. «Искра мала велик пламень родит», «Огонь да вода все сокрушат», «В огне и железо плавко», «Огонь - друг и враг человека».
Достаточно примеров. Они лишь должны напомнить, какую роль играет этот подарок природы в нашей жизни. Наш язык наделил его чертами живого существа и, наоборот, внешность и эмоции человека часто связывают со свойствами пламени.
Огонь издавна является неотъемлемой частью жизни людей. Можно ли представить наше существование без огня? Разумеется, нет. С процессами горения современный человек сталкивается ежедневно.
Цель работы: изучить процесс горения с разных точек зрения.
Изучить литературу и интернет ресурсы, связанные с темой горения;
Познакомиться с историей овладения огнем;
Найти информацию и точные инструкции по проведению опытов, связанных с процессами горения.
Горение - это первая химическая реакция, с которой познакомился человек.
По легенде огонь, замёрзшим и несчастным людям, принёс титан Прометей, не смотря на запрет Зевса. Но, скорее всего, первобытные человекоподобные особи столкнулись с огнём во время пожаров, вызванных ударами молний и извержением вулканов. Они не умели добывать его сами, но могли переносить и поддерживать его. Первые свидетельства использования людьми огня относятся к таким археологическим стоянкам древнего человека, как Чесованья в Восточной Африке, Сварткранс в Южной Африке, Чжоукоудянь и Сихоуду в Китае и Триниль, на острове Ява. Были найдены кострища, зола и древесные угли, датируемые 1,5-2 млн лет назад, обгоревшие орудия труда первобытных людей и кости млекопитающих.
Когда человек стал добывать огонь самостоятельно было доподлинно не известно до 2008 года, когда группа израильских археологов назвала относительно точную дату 790 тыс. лет назад. Такой вывод учёные сделали на основании результатов раскопок на известной раннепалеолитической стоянке Гешер-Бнот-Яаков. Согласно отчёту в журнале «Quaternary Science Reviews» они обнаружили следы применения примитивных средств для добывания огня, использовавшихся на протяжении жизни почти двенадцати поколений, заселявших данную местность. Так же выводы делались на основе более детальных исследований камней и каменных орудий, найденных здесь же ранее.
Первым способом самостоятельной добычи огня человеком было трение. Этот способ изредка используется и в наше время, например в походных условиях.
Постепенно, по мере накопления человечеством практического опыта и новых знаний об окружающем мире, на смену пришёл другой способ добывания огня, основанный на высекании искры. Он заключается в том, что при резком ударе камнем по некоторым минералам из их поверхности вылетают мельчайшие частицы, которые тут же воспламеняются и, попадая на горючий материал, поджигают его. К таким относится, например, пирит (дисульфид железа (II) - FeS 2). Известны и другие минералы с таким же свойством. С течением времени этот способ был усовершенствован: огонь стали получать, высекая искры из более распространенного и доступного минерала кремния железным кресалом. Горючими веществами были трут или пережженная пакля. Для получения огня таким способом в Европе вплоть до середины XIX в. Использовалось устройство, получившее в России название «огниво».
Ещё один интересный способ использовался с древности до середины ХХ века племенами островов Суматра, Ява, Калимантан и Сулавеси: добыча огня путем резкого сжатия воздуха в специальных приспособлениях.
В настоящее время, с процессами горения человек сталкивается постоянно. Это может быть горение газа в газовой плите, микровзрывы топлива в дизельных двигателях автомобилей, системы отопления в частных домах или работа тепловой электростанции и т. д. В военном деле под огнем понимается стрельба из огнестрельного оружия.
Огонь глазами ученого
Что же такое огонь? С точки зрения химии - это зона протекания экзотермической реакции окисления, иногда сопровождающейся пиролизом (термическим разложением органических и многих неорганических соединений). С точки зрения физики - испускание света нагретыми веществами из зоны такой реакции.
Почему мы видим огонь? Частички горючего материала и продукты горения светятся, потому что имеют высокую температуру (обычное излучение абсолютно черного тела). Высокая температура позволяет атомам перемещаться на некоторое время в более высокие энергетические состояния, а потом, по возвращении в исходное состояние, излучать свет определённой частоты, которая соответствует структуре электронных оболочек данного элемента.
В чем разница между «огнем» и «горением»? Огонь - это быстрая форма горения, при которой выделяются и свет и тепло. Горение - сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций. Для процесса горения необходимы:
Горючее вещество (топливо);
Окислитель (чаще всего кислород);
Источник зажигания (не всегда)
Окислитель и горючее вещество вместе составляют горючую систему. Она может быть однородной и неоднородной:
Однородными являются системы, в которых горючее вещество и окислитель равномерно перемешаны друг с другом (смеси горючих газов, паров). Горение таких систем называют горением кинетическим. При определенных условиях такое горение может носить характер взрыва.
Неоднородные - системы, в которых горючее вещество и воздух не перемешаны друг с другом и имеют поверхности раздела (твердые горючие материалы и не распылённые жидкости). В процессе горения неоднородных горючих систем кислород воздуха проникает сквозь продукты горения к горючему веществу и вступает с ним в реакцию. Такое горение называют диффузионным горением. В роли окислителя могут выступать кислород, хлор, фтор, бром и другие вещества.
Огонь основная (свободно горящая) фаза горения, это явление физико-химическое, значит, рассматривать его только с точки зрения химии неразумно. С точки зрения физики огонь - совокупность раскалённых газов, выделившихся в результате:
произвольного или непроизвольного нагревания топлива (горючего вещества) до определённой температуры при наличии окислителя;
химической реакции (например, взрыва);
протекания электрического тока в среде (электрическая дуга, электросварка)
Процесс горения делится на определенные стадии (фазы):
1. Начальная фаза (стадия роста),
2. Свободно горящая фаза (полностью развитая стадия),
3. Тлеющая фаза (стадия распада).
В первой - начальной - фазе расход приточного кислорода увеличивается, затем начинает уменьшаться. Вырабатывается некоторое количество тепла и это количество увеличивается в процессе горения. Пламя может нагреться до температуры более 5370°C, но температура в помещении на данном этапе может быть небольшая.
Во время второй - свободно - горящей фазы богатый кислородом воздух вовлечен в пламя, так как конвекция несет высокую температуру к верхнему слою ограниченного пространства. Горячие газы распространяются сверху вниз, вынуждая более прохладный воздух искать более низкие уровни, и, в конечном счете, зажигают весь горючий материал в верхних уровнях комнаты. На данном этапе температура в верхних слоях может превысить 7000°C. Огонь продолжает потреблять свободный кислород, пока он не достигнет точки, где недостаточно кислорода, чтобы реагировать с топливом. Пламя уменьшается до тлеющей фазы и нуждается только в поступлении кислорода, чтобы быстро вспыхнуть.
В третьей фазе пламя может прекратиться, если область горения воздухонепроницаема. В этом случае горение уменьшается до тлеющих угольков. Выделяется плотный дым и газы, возникает избыточное давление. Угли продолжают тлеть, помещение полностью заполнится плотным дымом и газами сгорания при температуре 5370°C. Сильный жар выпарит более легкие топливные составляющие, такие как водород и метан, от горючего материала в комнате. Эти топливные газы будут совместно с производными огня и далее увеличат опасность повторного возгорания и создадут возможность обратной тяги.
Виды горения
Вспышка - это быстрое сгорание горючей смеси, не сопровождающееся образованием сжатых газов.
Возгорание - возникновение горения под воздействием источника зажигания.
Ярким примером возгорания является «фокус» древнеиндийских жрецов: в древней Индии, при совершении священных обрядов, в полумраке храмов внезапно вспыхивали и рассыпались искрами таинственные красные огни, наводившие суеверный страх на молящихся. Разумеется, могучий Будда здесь был ни при чем, зато его верные служители, жрецы, пугали и обманывали верующих с помощью бенгальских огней. Соли стронция, придававшие пламени красный цвет, смешивались с углем, серой и хлоратом калия (бертолетовой солью). В нужный момент смесь поджигалась.
2KClO 3 + S +2C = 2KCl + SO 2 + 2CO 2
Самовозгорание - это явление резкого увеличения скорости экзотермических реакций, приводящее к возникновению горения веществ (материала, смеси) при отсутствии источника зажигания.
Тепловое самовозгорание вещества возникает в результате самонагревания под воздействием скрытого или внешнего источника нагрева. Самовоспламенение возможно только в том случае, если количество тепла, выделяемого в процессе самоокисления, будет превышать отдачу тепла в окружающую среду.
Примером теплового самовозгорания может служить самовозгорание летучих эфирных масел в жаркую погоду. Всем известная легенда о неопалимой купине, или Моисеевом кусте, имеет вполне научное объяснение: учёные полагают, что это был кустарник диптам, выделяющий эфирные масла, которые загораются под действием солнечных лучей. В безветренную погоду вокруг куста увеличивается концентрация летучих эфирных масел, выделяемых растением, которые воспламеняются по достижении определенной температуры. Уравнение химической реакции самовоспламенения эфира:
С 4 Н 10 О + 6О 2 = 4СО 2 + 5Н 2 О
Тепловым самовоспламенением также объясняется появление кладбищенских огоньков. При разложении органических остатков выделяется бесцветный, ядовитый газ фосфин (РН3), имеющий свойство самовозгораться на воздухе, т.е. при наличии кислорода. Если этот газ выходит из земли, с разлагающимися в ней органическими остатками, происходит самовоспламенение, образуются небольшие вспышки, которыми раньше церковники пугали суеверных людей. Такое явление можно наблюдать только в теплое время года, так как температура самовоспламенения фосфина = 38°C. Уравнение химической реакции самовоспламенения фосфина:
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O
Самовозгорание может происходить и под воздействием жизнедеятельности микроорганизмов в массе вещества (материала, смеси).
Склонностью к микробиологическому самовозгоранию обладают горючие материалы, особенно увлажненные, служащие питательной средой для микроорганизмов, жизнедеятельность которых связана с выделением теплоты (торф, древесные опилки). При этом температура самонагревания не превышает обычных значений температуры окружающей среды и может быть отрицательной.
Поэтому большинство пожаров и взрывов происходит при хранении сельскохозяйственных продуктов (силос, увлажненное сено) в элеваторах. Наиболее часто используемый способ избежать самонагревания и самовоспламенения сена (и подобных материалов) сводится к тому, чтобы при складировании этих материалов не происходило их увлажнение.
Существует различие между процессами возгорания и самовозгорания: для того чтобы возникло возгорание, необходимо внести в горючую систему тепловой импульс, имеющий температуру, превышающую температуру самовоспламенения вещества.
Температура самонагревания - минимальная температура среды, выше которой при благоприятных условиях возможно развитие экзотермического процесса самонагревания, связанного с термическим разложением и окислением определенного объема (массы) горючего вещества.
Температура самовоспламенения - это самая низкая температура вещества, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся возникновением пламенного горения.
Взрыв - это чрезвычайно быстрое химическое превращение вещества, сопровождающееся быстрым выделением тепловой энергии и образованием сжатых газов, способных производить механическую работу.
Без этого типа горения так же сложно представить современный мир, так как механический взрыв топлива лежит в основе работы большинства автомобильных двигателей. Также взрывы небольших масштабов используются в пиротехнических устройствах. Пиротехника (др. греч. πῦρ — огонь, жар; τεχνικός — искусство, мастерство) — отрасль техники, связанная с технологиями приготовления горючих составов и сжигания их для получения определённого эффекта. Делится на:
военную (сигнальные ракетницы, дымовые шашки)
специализированную (киносъемочные спецэффекты, гражданские сигнальные средства)
развлекательную (пиротехнические изделия - петарды, бенгальские огни, хлопушки, салюты.
В ходе процесса горения образуются продукты сгорания. Они могут быть жидкими, твёрдыми и газообразными. Их состав зависит от состава горящего вещества и от условий его горения. Органические и неорганические горючие вещества состоят, главным образом, из углерода, кислорода, водорода, серы, фосфора и азота. Из них углерод, водород, сера и фосфор способны окисляться при температуре горения и образовывать продукты горения: СО, CO 2 , SO 2 , P 2 O 5 . Азот при температуре горения не окисляется и выделяется в свободном состоянии, а кислород расходуется на окисление горючих элементов вещества. Все указанные продукты сгорания (за исключение угарного газа СО) гореть в дальнейшем не способны.
При неполном сгорании органических веществ в условиях низких температур и недостатка воздуха образуются более разнообразные продукты - оксид углерода(II), спирты, альдегиды, кислоты и другие сложные химические соединения. Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала.
Цвет пламени
Способность примесей окрашивать пламя в различные цвета используется не только в пиротехнике, но и в аналитической химии: пирохимический анализ - метод обнаружения некоторых химических элементов (например, в минералах) по различному окрашиванию пламени.
|
Элемент |
Цвет пламени |
|
Изумрудно-зеленый |
|
|
Кобальт (Co) |
|
|
Марганец (Mn) |
Фиолетово-аметистовый |
|
Железо (Fe) |
Желто-бурый |
|
Никель (Ni) |
Красно-бурый |
|
Натрий (Na) |
Оранжевый |
|
Кальций (Ca) |
Ярко-красный |
Газовая горелка горит голубым пламенем из-за наличия угарного газа(СО). Жёлто-оранжевое пламя спички объясняется наличием солей натрия в древесине. Жёлто-оранжевый цвет верхушки пламени при обычных условиях объясняется свечением частичек сажи, уносимых вверх потоком горячего воздуха.
Заключение
В результате работы над темой выполнены поставленные задачи: изучены литературные источники и Интернет-ресурсы об истории овладения огнем и о процессах горения; подобраны лабораторные опыты, связанные с процессами горения и инструкции для их проведения.
Цель работы достигнута. Такое, казалось бы, привычное для современного человека явление, как горение, является сложнейшим физико-химическим процессом. Это первая химическая реакция, с которой познакомился человек! Этот процесс играет весьма важную роль в нашей жизни, хотя порой и представляет большую опасность.
Интересные факты и лабораторные опыты, представленные в работе, можно использовать в демонстрационных целях в образовательных учреждениях для ознакомления учащихся с такой удивительной темой, как огонь.
Практическая часть
Опыт №1. «Химический фитиль».
Такой способ дистанционно поджигать запалы для бомб использовали еще в конце 19 века. Он основан на способности глицерина возгораться от реакции с сильным окислителем (перманганатом калия).
Цель эксперимента: убедиться, что огонь может «рождаться» не только от искры, но и просто от смешивания некоторых веществ, которые по отдельности совершенно безобидны.
Реактивы и оборудование: бумага, кристаллический перманганат калия, безводный глицерин, пипетка.
Ход работы и наблюдения: на скомканный лист бумаги высыпать небольшое количество перманганата калия, капнуть 3-5 капель глицерина; над смесью появится дым, и через какое-то время (5-15 секунд) смесь и скомканный лист загорятся.
Опыт №2 . «Мини-фейерверк».
Реактивы и оборудование: растолченный в порошок древесный уголь, кристаллический перманганат калия, железные опилки, лист бумаги, тигль, тигельные щипцы, сухое горючее.
Ход работы и наблюдения: на лист бумаги насыпаем три небольшие одинаковые кучки мелко растолченных порошков: перманганата калия, железных опилок и угля. После этого складываем лист бумаги пополам так, чтобы порошки ссыпались в одну кучку. Дело в том, что при перетирании марганцовки с железными опилками, смесь может вспыхнуть. Полученную смесь высыпаем в тигль. Подносим его к пламени сухого горючего и ждем несколько секунд. Когда смесь нагреется, она начнет искрить, подобно бенгальскому огню.
Опыт №3. «Негасимый магний».
Магний - одно из немногих веществ, которые невозможно потушить водой.
Реактивы и оборудование: магний, вода, стакан, ложка с длинной ручкой, спиртовка.
Ход работы и наблюдения: небольшое количество магния, находящегося в ложке, зажигаем от пламени спиртовки. Помещаем горящий магний в стакан с водой, и наблюдаем, что он не потух, а продолжает гореть, оставшись на поверхности воды.
Опыт №4«Фараонова змея из глюконата кальция».
Фараоновыми змеями называют целый ряд реакций, которые сопровождаются образованием пористого продукта из небольшого объема реагирующих веществ. Эти реакции сопровождаются бурным выделением газа.
Цель эксперимента: понаблюдать за термическим разложением глюконата кальция.
Реактивы и оборудование: таблетки глюконата кальция, сухое горючее, пинцет.
Ход работы и наблюдения: на зажженную таблетку сухого горючего, при помощи пинцета, кладём 1-2 таблетки глюконата кальция. Глюконат кальция значительно увеличится в объёме, приобретёт «червеобразную» форму, будет «выползать» из пламени. Получившаяся «змея» очень хрупкая и распадётся при первом же прикосновении.
Опыт №5. «Содовая гадюка».
Цель эксперимента: понаблюдать за термическим разложением смеси соды и сахарной пудры.
Реактивы и оборудование: песок, сода, сахарная пудра, спирт.
Ход работы и наблюдения: насыпаем немного песка (4-5 столовых ложек), делаем небольшое углубление на вершине получившейся «пирамиды». В это углубление высыпаем смесь из равного количества соды и сахарной пудры. Поливаем всё это спиртом, поджигаем. Сначала наблюдаем образование небольших тёмных пузырьков, затем появление самой «содовой гадюки». Как и в предыдущем опыте, фараонова змея постепенно увеличивается в размерах.
Опыт №6. «Взрыв смеси газов».
Цель эксперимента: понаблюдать за взрывом смеси воздуха с горючим газом.
Реактивы и оборудование: цинк, соляная кислота, прибор для получения газов, стакан с водой, средство для мытья посуды, зажженная лучинка.
Ход работы и наблюдения: в стакан с водой наливаем немного моющего средства, перемешиваем для образования лёгкой пенки. Смешиваем цинк и соляную кислоту в приборе для получения газов, газоотводную трубку направляем в стакан с водой и моющим средством. При взаимодействии цинка с соляной кислотой выделяется водород, который образует пену в стакане. Когда наберется достаточное количество
пены, убираем газоотводную трубку, подносим горящую лучинку к пене и наблюдаем небольшой взрыв.
Опыт №7. «Цветное пламя».
Реактивы и оборудование: хлорид меди, сульфат меди (II), поваренная соль, фторид кальция, хлорид аммония, вода, спиртовка, петелька из нихромовой проволоки.
Ход работы и наблюдения: хлорид аммония в соотношении 1:1 смешиваем с каждым из реагентов, разбавляем водой и перемешиваем образовавшуюся кашицу. Затем поддеваем небольшое количество каждого из веществ петелькой из нихромовой проволоки и вносим в пламя горелки, наблюдаем за реакцией окрашивания пламени. В итоге получилось: исходное пламя было прозрачным, с синеватым оттенком; хлорид натрия (поваренная соль) окрасил пламя в жёлтый; сульфат меди (II) - медный купорос - в зелёный; хлорид меди - в светло синий, а фторид кальция придал пламени едва заметный красный оттенок.
Список литературы
1. .Кендиван, О.Д.-С. Чудо глазами химика / О.Д.-С. Кендиван //Химия. Учебно-методический журнал для учителей химии и естествознания №5-6 изд. Первое сентября - Москва, 2014. - С.45-52
2. Красицкий, В.А. Рукотворный огонь: история и современность / В.А. Красицкий // Химия. Учебно-методический журнал для учителей химии и естествознания №1 изд. Первое сентября - Москва, 2014. - С.4-8
3. Неизвестен. Аналитическая химия. Полумикроанализ [Электронный ресурс] / Неизвестен // Аналитическая химия - Режим доступа: http://analit-himiya.ucoz.com/index/0-13
4. Неизвестен. Горение [Электронный ресурс]/ Неизвестен// Свободная энциклопедия Википедия - Режим доступа: https://ru.wikipedia.org/wiki/Горение
5. Полтев, М.К. Глава Х. Пожарная безопасность. §1. Процессы горения / М.К. Полтев // Охрана труда в машиностроении, изд. «Высшая школа» - Москва, 1980.
6. Рюмин, В.В. Горение без воздуха / В.В. Рюмин // Занимательная химия, 7-е изд. Молодая гвардия. - Москва, 1936. - С.58-59
7. Рюмин, В.В. Самовоспламенение / В.В. Рюмин// Занимательная химия, 7-е изд. Молодая гвардия. - Москва, 1936. - С.59
8. Степин, Б. Д.; Аликберова, Л.Ю. Эффектные опыты / Б.Д. Степин, Л.Ю. Аликберова // Занимательные задания и эффектные опыты по химии изд. Дрофа - Москва, 2006. - С.
Введение
Актуальность темы. Без огня невозможна жизнь на Земле. Мы видим огонь каждый день – плита, костер, печка и т.д. Он всюду – в домах и школах, на заводах и фабриках, в двигателях космических кораблей. Вечный Огонь горит на площади Славы, в храмах всегда горят свечи …
Все лето по телевизору показывали лесные пожары. Сгорело безвозвратно большое количество деревьев, которые давали нам воздух. Могли бы стать интересными книгами и нашими школьными тетрадями. Погибли животные. Сгорели целые деревни, люди остались без жилищ.
Интересный и загадочный этот огонь!
Для детей о пожарах и мерах безопасности написано достаточно много книг, в том числе литературных произведений (“Дядя степа” С. Михалкова, “Путаница” К. Чуковского, “Кошкин дом” С. Маршака и т.д.). Но такие источники, в которых описываются подробно и свойства огня, и его польза встречаются редко. Наша работа – это попытка восполнить такой пробел.
Цель работы: Исследование значения огня для человека.
Задачи. В этой работе мы изучаем свойства огня и отвечаем на вопрос: Что такое огонь? Также разбираемся, как эти свойства используют люди. Каким образом и почему огонь может помочь и навредить людям? (Приложение 1).
Мы использовали справочную литературу: словарь, энциклопедию, некоторые книги для взрослых, и информацию из сети Интернет.
1. Что такое огонь? Основные свойства огня
В детской энциклопедии есть такое определение огня и горения: “это химическая реакция, в которой одно из веществ настолько нагревается, что соединяется с кислородом воздуха”. В толковом словаре русского языка читаем: “Огонь – горящие светящиеся газы высокой температуры” . После прочтения этой информации, автор данной работы так и не понял, что же такое огонь и решил дать такое ему определение, которое было бы понятно ученикам начальной школы. Для этого нужно выявить основные его свойства.
Основные свойства огня изучаем при помощи методов эксперимента (опытов) и наблюдения. Проделаем несколько опытов.
Примечание. Все опыты проводились в присутствии и с помощью взрослых, при этом были соблюдены правила безопасности: использовали негорящую поверхность (стеклянную доску) и приготовили кувшин с водой.
Описание опытов:
Опыт № 1. В темное время суток выключили в комнате свет. Стало темно, ничего не видно. Зажгли свечу, стали видны очертания предметов и людей.
Вывод: 1 свойство: Огонь излучает свет! (См.: Приложение , слайд 4)
Даже небольшое пламя свечи может освещать комнату. Вот почему в запасе у мамы всегда есть свечи – на случай отключения электричества.
Опыт № 2. Очень осторожно попробуем поднести руку к пламени свечи. На расстоянии 20 см становится очень тепло, ниже – из-за жжения опустить руку нельзя.
Вывод: 2 свойство: Огонь выделяет много тепла! (См.: Приложение, слайд 5).
Опыт № 3. Накроем горящую свечу стеклянной банкой. Через несколько секунд пламя гаснет. То же происходит и с газовой конфоркой. Для достоверности мы повторили опыт 3 раза. Результат всегда один – пламя прекращает гореть.
Вывод: 3 свойство: для того, чтобы огонь горел, нужен воздух, а точнее кислород, который он содержит. (См.: Приложение, слайд 6).
Итак, мы выяснили главные свойства огня и уже можем ответить на вопрос: что такое огонь?
Огонь – это такой процесс, при котором поглощается кислород и выделяется свет и тепло.
Продолжим изучение свойств огня.
1) Наблюдаем за пламенем свечи. Форма спокойного пламени, заостренная кверху похожа на конус. Если потихоньку подуть на пламя свечи, то форма меняется, оно отклоняется от потока воздуха. То же происходит, если поднести свечу к приоткрытому окну.
Вывод: форму пламени можно изменить при помощи потока воздуха. Это свойство используют при разжигании костра. (См.: Приложение, слайды 9,10,11).
2) Рассмотрим цвет пламени. Цвет не везде одинаков, пламя имеет слои: самый нижний слой голубоватого оттенка, затем светло-желтый слой, после него – самый верхний красновато-оранжевый. (См.: Приложение, слайд 13).
Но это еще не все о цвете.
Мы заметили, что газ на кухне всегда горит голубым цветом, а дерево - желто-оранжевым. Наблюдая за горением тонкую проволочку из меди, от электрического шнура, мы обнаружили, что пламя при этом окрашивается в зеленый цвет. (См.: Приложение, слайды 14, 17, 18, 19).
Выводы: 1. Разные вещества и материалы горят с разным цветом пламени. Так вот как получается такой красивый фейерверк! 2. Значит можно определить, неизвестное вещество по цвету пламени, надо только поджечь (как один из способов).
Опыт № 5. Температура пламени. Возьмем ту же тонкую медную проволочку. Кончик такой проволочки, держа ее поперек пламени, помещаем в разных местах и на различной высоте в пламя и наблюдаем действие пламени на проволочку. Наблюдения обнаруживают следующее:
- В нижней части пламени проволочка не светится, не горит, только покрылась черным налетом.
- В средней части проволочка накаливается, начинает светится красным цветом.
- В самой верхней части пламени проволочка загорается, окрашивая пламя в зеленоватый оттенок.
Значит, температура в разных слоях пламени различная. Это подтверждается и опытом с поднесением к пламени руки. Мы помним, что сверху можно поднести руку только на 20 см. Если поднести палец к нижней части пламени, тепло чувствуется только на расстоянии 1 см.
Вывод: пламя имеет несколько слоев, отличающихся не только по цвету, но и температурой. В нижней части пламя самое холодное, а верхней – самое горячее. (См.: Приложение, слайд 20).
2. Значение огня: польза и вред
В результате проведенных опытов, собственных наблюдений, а также из прочитанного материала мы убедились, что люди постоянно используют огонь в своей жизни, и он приносит им очень большую пользу.
- В быту: для отопления помещений, приготовления пищи, нагревания воды, освещения - если электричество не работает. Еще огонь служит для уюта. Например, камин или ароматические свечи.
- Как оказалось, полезные свойства огня используют на многих заводах и фабриках. Огонь плавит металл, после чего ему придают какую-нибудь форму. Также огнем режут металл или наоборот, сваривают его. Таким образом, его используют, например, для того, чтобы делать различные машины и механизмы.
Еще огонь используется при:
- Изготовлении стеклянной и глиняной посуды.
- Производстве пластмасс, красок.
- Изготовлении лекарств.
- Переработке отходов.
И это еще не весь список “добрых” дел огня.
Вывод: Огонь очень нужен людям. Он согревает, кормит и освещает. Современный человек использует огонь постоянно. Невозможно представить себе жизнь без огня.
Но огонь очень опасен! Его всегда нужно контролировать. Он способен и очень навредить. Речь идет о пожарах. Пожар – это когда огонь горит без желания человека и все разрушает.
Большой ущерб нашему государству и населению приносят пожары. Пожар – явление очень страшное, жестокое, враждебное всему живому. (См.: Приложение, слайд 26).
Пожар вреден тем, что: от пожаров гибнут люди и получают сильные ожоги, люди лишаются дома, от пожаров исчезают леса и гибнут все их обитатели: животные, птицы, пожар может уничтожить все, что человек создавал своим трудом.
Немного статистики. Только представьте, что ежегодно в мире происходит около 5 миллионов пожаров! Каждый час в огне погибает один человек, два получают травмы и ожоги. Каждый третий погибший – ребенок.
Как они возникают? Из-за неосторожного обращения с огнем, недобросовестного отношения к мерам безопасности.
О пожарах, о бедах, которые приносит огонь написано много книг. В том числе детских. Почему же для детей написано много книг о пожарах? Мы думаем, что потому что пожары очень часто возникают по вине детей.
Хотим напомнить всем ребятам:
Никогда не играйте с огнем!
Разжигать огонь можно только в присутствии взрослых и под их присмотром.
В местах разведения костров, другого использования огня должны быть под рукой средства тушения.
Нельзя оставлять огонь без присмотра.
Когда огонь уже не нужен, он должен быть хорошо потушен.
Заключение
Таким образом, в результате проведенной работы мы дали понятное для детей определение огня: “Огонь – это такой процесс, при котором поглощается кислород и выделяется свет и тепло”.
А также выяснили: Пламя имеет определенную форму, несколько слоев, отличающихся не только по цвету, но и температурой. При этом форму пламени можно изменить при помощи потока воздуха. Знание этих свойств помогает людям использовать огонь более эффективно.
Разные вещества и материалы горят с разным цветом пламени. Значит можно определить, какое-то вещество по цвету пламени, надо только поджечь (как один из способов).
Вообще, огонь очень нужен людям, он согревает, кормит, освещает. Современный человек использует огонь постоянно. Невозможно представить себе жизнь без огня.
Но огонь очень опасен! Его всегда нужно контролировать, нельзя оставлять без присмотра. Он способен и очень навредить. Пожар – явление очень страшное, жестокое, враждебное всему живому.
Конечно, мы исследовали не всё о таком удивительном явлении как огонь. Поэтому в дальнейшем возможно исследовать такие вопросы: как люди научились разжигать огонь, каковы были первые способы? Какие вещества не горят и почему? Как делают фокусы с огнем? Также интересна тема “Огонь и оружие”.
Результаты данной работы можно использовать как вспомогательный материал на занятиях о мире вокруг нас (окружающему миру) в детском саду и начальной школе. Для детей интересующихся огнём такой материал будет полезен, потому что он наглядный и достаточно простой.
Список источников и литературы
- Джон Фарндон, Ян Джеймс, Джинни Джонсон, Анжела Ройстон, и др. Энциклопедия “Вопросы и ответы”. Перевод с англ.: Е. Куликова, Д. Беленькая и др. ООО “Издательская группа Аттикус”, 2008. 255 с.
- Кайданова О.В (составитель) Огонь и человек. Москва, 1912. 98 с.
- Ожегов С.И. Словарь русского языка: М.: Рус. яз., 1984. 797 с.
- Сафронов М.А., Вакуров А.Д. Огонь в лесу. Новосибирск: наука, 1991. 130 с.
- Интернет-ресурсы:
Стихия огня. http://salamand.ru/sootvetstviya-stixii-ognya
Российская статистика. http://www.statp.ru